
Растущее число исследований показало, что насекомые и членистоногие могут действовать как распространяющие агенты и пассивно передавать патогены потенциальным хозяевам, при этом сами не заражаясь. Например, в почвенной среде коллемболы могут способствовать распространению грибков, неся конидии, прикрепленные к их телу или расположенные в кишечнике. У медоносных пчел и шмелей форетные клещи Варроа были идентифицированы как распространенные переносчики вирусов и грибков, вызывающие гибель и разрушение пчелиных и шмелиных семей. Следовательно, членистоногие-переносчики могут формировать прямые и косвенные взаимодействия между патогеном и его хозяином и, следовательно, влиять на динамику их популяции. Хотя такие взаимодействия должны быть обычными по своей природе, роль членистоногих, в процессе разнесения патогенов, остается малоизученной.
В борьбе с вредителями, как показывает практика, использование какого-то одного средства контроля их популяции, зачастую имеет невысокую эффективность. В поисках новых средств и методик борьбы с фитофагами возник вопрос определения взаимодействий между энтоматопатогенами и хищниками, способность хищников транспортировать патогены в колонии вредителей, в попытке использовать комбинации этих двух средств биологического контроля вредителей.
Членистоногие могут увеличить скорость, с которой болезнь горизонтально передается восприимчивым хозяевам, либо через прямой физический контакт (например, во время хищничества или попытки паразитизма), либо косвенно, высвобождая инфекционные пропагулы (споры грибов) в среду обитания. В таких случаях, когда существует тесная ассоциация между агентом распространения и хозяином, чувствительным к патогену, встреча между взаимодействующими видами не является случайным событием. Например, способность хищника распространять грибковые конидии на свою добычу будет в первую очередь зависеть от того, как конидии удаляются с кутикулы (либо вовремя чистки, либо при ходьбе), и от его поведения при поиске пищи (например, местонахождение среды обитания, поисковое поведение с ограниченной областью поиска), которые способствуют увеличению пространственного совпадения с жертвой.
Beauveria bassiana – энтомопатогенный гриб, который в качестве хозяина может использовать более 200 видов из большинства отрядов насекомых, при этом некоторые изоляты демонстрируют высокую степень специфичности. Конидии могут быть разнесены как посредством движения воздуха благодаря микроскопическим размерам (1-3 мкм), так и при контакте с инфицированными хозяевами или через агентов распространения. Конидии прикрепляются к кутикуле хозяина, прорастают, проникают в хозяина с помощью ферментативных и механических процессов, а затем воспроизводятся, используя гемолимфу и различные ткани хозяина. Как только питательные вещества хозяина истощаются, гриб пробивает кутикулу изнутри и образует большое количество спор. Коммерческие штаммы B. bassiana используются для борьбы с вредителями в программах биологической защиты. Их обычно распыляют на посевы, как пестициды, и вероятность контакта с хозяином зависит от пространственного распределения вредителей.
Многоядное насекомое, которое питается почти всеми частями растений, от листьев до цветов и стручков, оно также может переносить ряд растительных вирусов. Frankliniella occidentalis может прятаться в скрытых частях растений, где пестициды не могут добраться до них.
В качестве хищных клещей, питающихся трипсами и способных переносить споры Beauveria bassiana были выбраны Amblyseius cucumeris и Amblyseius swirskii.
Материал A. cucumeris, содержался на Темноногом клеще (Aleuroglyphus ovatus) в качестве корма, в то время как A. swirskii, выращивался на диетической смеси, содержащей Винного клеща (Carpoglyphus lactis) и пыльцу вишни. Frankliniella occidentalis был получен из лабораторной колонии и выращена на растения красной фасоли (Phaseolus vulgaris) с пыльцой вишни. Все колонии выдерживали при 25 °C, относительной влажности 60-70 % и световом цикле 14/10 (свет/тьма). Штамм Beauveria bassiana ANT-03 был зарегистрированный для борьбы с трипсами. Для всех экспериментов был использован порошок B. bassiana технической чистоты, содержащий 5×1010 КОЕ/г.
 Рисунок 1. Схематический рисунок структуры фасолевого растения после обрезки (слева). Каждая часть растения (листок и стебель) обозначена номером (справа). Пробирка Эппендорфа, содержащая хищных клещей и грибковые конидии, которые нужно высвободить, была прикреплена в позиции 8. Пример пространственного распределения личиночных трипсов проиллюстрирован с использованием желтых овальных пятен — в этом случае трипсы в основном скапливаются на листке 5 яйцекладки.
Рисунок 1. Схематический рисунок структуры фасолевого растения после обрезки (слева). Каждая часть растения (листок и стебель) обозначена номером (справа). Пробирка Эппендорфа, содержащая хищных клещей и грибковые конидии, которые нужно высвободить, была прикреплена в позиции 8. Пример пространственного распределения личиночных трипсов проиллюстрирован с использованием желтых овальных пятен — в этом случае трипсы в основном скапливаются на листке 5 яйцекладки.Чтобы проверить способность хищных клещей доставлять B. bassiana трипсам, ученые сначала установили разделили растение на части, зараженные и не зараженные трипсами. Чтобы стандартизировать структуру растения, сначала обрезали фасоль (примерно 20 см в высоту) до двух трехлистников (рис. 1). Чтобы создать скопление личинок трипсов на растении, было помещено 25 яйцекладущих самок трипсов на 24 часа в зажимную сетчатую клетку на одном листе. Предполагалось, что в период откладки яиц самки трипса питались и оставляли на листе ароматические следы, которые в дальнейшем могут использоваться хищными клещами для определения местонахождения жертвы. Чтобы избежать потенциальной экспериментальной ошибки, связанной с возрастом или положением листьев, половина растений имела трипсы на листке 2 (Рис.1), средний лист более старого тройчатого листа, в то время как второй набор растений имел трипсы на листе 5, средний лист молодого тройчатого листа (Рис.1). После откладки яиц с растения удаляли клетку-зажим и самок трипса. Четыре дня спустя, когда большинство яиц превратилось в личинок первого возраста, были выпущены хищные клеще, с нанесенной на них B. bassiana на растении.
Взрослые самки хищных клещей разного возраста подвергались воздействию конидий B. bassiana в коммерческом субстрате в течение двух часов для получения максимальной нагрузки конидий на их тело (рис. 2). В модифицированную пробирку Эппендорфа было помещено 25 хищных клещей с 0,2 г субстрата, зараженного B. bassiana. Пробирка прикреплялась к стеблю на равном расстоянии от основания черешка двух тройчатых листьев (рис. 1).
 Рисунок 2. Конидии B. bassiana на кутикуле Amblyseius cucumeris
Рисунок 2. Конидии B. bassiana на кутикуле Amblyseius cucumerisЧтобы контролировать распространение конидий B. bassiana по воздуху и возможное механическое нарушение во время экспериментальных манипуляций, к растению прикрепляли пробирку, содержащую 0,2 г субстрата, зараженного B. bassiana (контрольная обработка). Каждое растение было изолировано в бумажном цилиндре, а внутренние стенки и дно бумажного цилиндра были покрыты кольцами клея для предотвращения распространения конидий и хищных клещей между экспериментальными единицами. Для каждого набора растений (лист 2 против листа 5) было три обработки: контроль, A. cucumeris, обработанный B. bassiana, и A. swirskii, обработанный B. bassiana. Эксперимент повторяли девять раз с двумя растениями на обработку в каждом блоке при 25 °C, относительной влажности 60-70 % и световом цикле 14/10 (день/ночь). Два блока, в которых трипсы не оставались на растениях, были исключены из анализа доли трипсов, несущих B. bassiana, поскольку этот параметр невозможно оценить в отсутствие трипсов.
Через 48 часов после выпуска клещей-фитосейид, растения были тщательно исследованы, чтобы установить количество и пространственное распределение выживших хищников и жертв. Каждую из девяти частей растения (рис. 1) собирали и помещали в одну чашу объемом 60 мл с крышкой. Чаша была наполнена углекислым газом, чтобы остановить движение трипсов и хищных клещей, облегчить обращение и избежать перекрестного заражения грибками между особями. Регистрировали количество живых клещей и трипсов на каждой части растения. Предполагалось, что гибель трипсов является результатом присутствия хищников, поскольку конидии B. bassiana не могут прорасти и проникнуть в ткани трипсов в течение 48 часов.
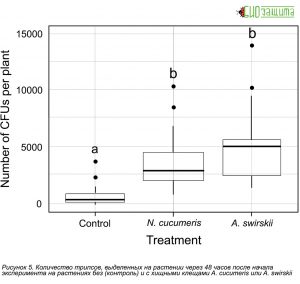 Рисунок 3. Количество колониеобразующих единиц (КОЕ) B. bassiana, выделенных на растении через 48 часов после начала эксперимента на растениях без (контроль) и с хищными клещами, A. cucumeris или A. swirskii.
Рисунок 3. Количество колониеобразующих единиц (КОЕ) B. bassiana, выделенных на растении через 48 часов после начала эксперимента на растениях без (контроль) и с хищными клещами, A. cucumeris или A. swirskii.Чтобы обнаружить присутствие или отсутствие B. bassiana на живых трипсах, которые оставались на растениях до конца эксперимента, трипсы были индивидуально собраны с помощью стерилизованной зубочистки или чистой тонкой щетки и помещены в небольшую чашку Петри (Ø 35 мм), содержащую 2,5 мл питательной среды для B. bassiana. Чашки Петри исследовали через 10 дней, когда можно было визуализировать количество колониеобразующие единицы (КОЕ). Рассчитывали долю трипсов, несущих конидии.
Чтобы оценить количество конидий на каждой части растения после удаления членистоногих, листья и стебли разрезали на небольшие кусочки (<2 см шириной и длиной) и помещали обратно в одиночную чашку. Конидии смывали в каждую чашку, и чашки помещали на роторный шейкер на 2 часа при скорости 125 об/мин. Затем одну пробу суспензии 0,5 мл переносили на питательную среду для B. bassiana, и через 9 дней подсчитывали количество КОЕ. Для каждого растения отмечали сумму КОЕ, доставленных на все растение, и, более конкретно, количество и пропорцию КОЕ на листе, где самки трипса откладывали яйца.
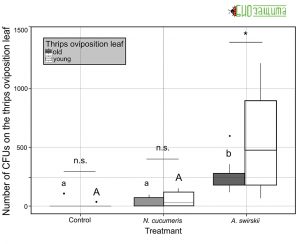 Рисунок 4. Количество колониеобразующих единиц (КОЕ) B. bassiana, выделенных из яиц трипса (молодые против старых) через 48 часов после начала эксперимента на растениях без (контроль) и с хищными клещами, N. cucumeris или А. swirskii.
Рисунок 4. Количество колониеобразующих единиц (КОЕ) B. bassiana, выделенных из яиц трипса (молодые против старых) через 48 часов после начала эксперимента на растениях без (контроль) и с хищными клещами, N. cucumeris или А. swirskii.В ходе проведенных опытов были получены следующие данные приведенные на рисунках 3-6. Количество КОЕ, собранных из всего растения, значительно различается между обработками. Как A. swirskii, так и A. cucumeris способствовали увеличению общего количества КОЕ на растениях по сравнению с контролем (Рис. 3). Одно растение из контрольной обработки было исключено из анализа, так как на одном листе высадилось чрезвычайно большое количество конидий (~ 19 800).
Было обнаружено взаимодействие между листом, в котором были отложены яйца трипса, и обработкой. Для A. swirskii количество спор было больше, когда яйца трипса откладывались на молодой лист, чем на старый. Amblyseius swirskii увеличивал количество КОЕ, выделенных из листа, в котором были отложены яйца трипса, по сравнению с контролем и растениями, на которые выселяли A. Cucumeris (Рис. 4).
В ходе эксперимента было невозможно загрузить два вида хищных клещей с одинаковым количеством конидий. Таким образом, оценивали долю B. bassiana, доставленную к листу, в котором были отложены яйца трипса, двумя видами хищных клещей. Доля КОЕ, извлеченных из листа, в котором были отложены яйца трипса, варьировалась между обработками, при этом A. swirskii увеличивал долю B. bassiana на листе для откладки трипса по сравнению с контролем, но не с A. cucumeris. Amblyseius swirskii доставлял значительно более высокую долю B. bassiana на лист, на котором трипс откладывал яйца, чем A. cucumeris.
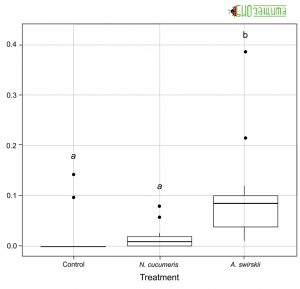 Рисунок 5. Количество трипсов, выделенных на растении через 48 часов после начала эксперимента на растениях без (контроль) и с хищными клещами A. cucumeris или A. swirskii
Рисунок 5. Количество трипсов, выделенных на растении через 48 часов после начала эксперимента на растениях без (контроль) и с хищными клещами A. cucumeris или A. swirskiiЧерез сорок восемь часов после выпуска хищных клещей из растений было извлечено большее количество A. swirskii, чем A. cucumeris. Количество трипсов, оставшихся на растениях в конце эксперимента, также варьировало между обработками (Рис. 5). Amblyseius swirskii сильнее снижал количество трипсов на растениях.
Результаты проведенного исследования показывают, что A. swirskii и A. cucumeris обладают способностью распространять конидии B. bassiana на растениях во время кормления. Однако A. swirskii более эффективен, чем A. cucumeris, поскольку они доставляют более высокую долю конидий в колонии трипсов.
Есть два основных способа, которыми конидии могут быть отделены от тела хищного клеща и рассеяны по растению. Их могут либо активно убирать клещи во время чистки, либо стирать о поверхность растения, когда хищные клещи передвигаются. Чистка, с помощью ног, наблюдается у фитосейидных клещей, когда они сталкиваются с потенциально патогенными грибами. Однако чистка неэффективна для удаления всех конидий с тела клещей, особенно тех, которые расположены на спинных участках их тела. Также выявлено, что A. swirskii и A. cucumeris в основном удаляли конидии со своего тела, ходя по поверхности растения. Действительно, продолжительность ходьбы влияет на удаление конидий у обоих видов. Трихомы и другие структуры, связанные с поверхностью листьев бобов, способствуют удалению конидий при ходьбе клещей (рис. 6B). Таким образом, хищные клещи, в поисках пищи, активно распространяют конидии B. bassiana в окружающей среде.
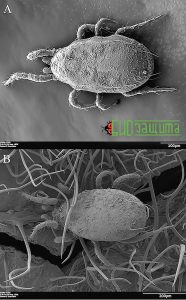 Рисунок 6. (A) Amblyseius cucumeris с конидиями Beauveria bassiana. (B) Amblyseius swirskii с конидиями Beauveria bassiana, выпущенными на бобовый лист. Волосковидные структуры представляют собой плотные бобовые трихомы.
Рисунок 6. (A) Amblyseius cucumeris с конидиями Beauveria bassiana. (B) Amblyseius swirskii с конидиями Beauveria bassiana, выпущенными на бобовый лист. Волосковидные структуры представляют собой плотные бобовые трихомы.При посредничестве хищных клещей передача конидий трипсу может быть пассивным или активным процессом. Конидии выгружаются на поверхность растений и могут впоследствии пассивно прикрепляться к кутикуле трипсов, когда они кормятся на загрязненном субстрате. В качестве альтернативы, конидии могут напрямую передаваться от хищных клещей трипсам во время неудачного случая хищничества, включающего физический контакт между хищником и жертвой. Присутствие хищных клещей в непосредственной близости от колоний трипсов может влиять на их поведение. После обнаружения хищников трипсы могут переключаться с постоянного питания на побег, тем самым увеличивая вероятность контакта со спорами, рассеянными на поверхности растений.
Наблюдаемые различия между A. swirskii и A. cucumeris в их способности распространять конидии B. bassiana в колонии трипсов могут возникать из-за различий в способах кормления хищников. Как выяснено A. swirskii, подавлял трипсов сильнее, чем A. cucumeris в экспериментальной установке. Разница в пропорциях конидий, доставляемых в места сосредоточения трипсов двумя видами хищных клещей, свидетельствует о лучшей способности A. swirskii поражать трипсов на фасолевых растениях.
Скорость, с которой B. bassiana контактирует со своим хозяином, имеет решающее значение в контексте биологического контроля не только потому, что она напрямую связана со скоростью заражения, но и потому, что жизнеспособность конидий очень чувствительна к условиям окружающей среды, таким как УФ и влажность. В некоторых случаях, применение B. bassiana, как самостоятельного средства контроля вредителей, неэффективно для борьбы с целевыми вредителями. Например, западные цветочные трипсы часто прячутся в расщелинах растений и бутонах. В результате распыление патогенных грибков мало влияет на уровень зараженности трипсами. В таких обстоятельствах способность хищных клещей доставлять болезнетворные микроорганизмы и грибки в колонии трипсов может увеличить передачу болезни. В проведенном эксперименте смертность трипсов после контакта с патогенами не оценивалась. Тем не менее, было показано, что ЛД50 является относительно низкой для порошка B. bassiana технической чистоты: примерно 50 конидий на личинку F. occidentalis 2-го возраста и только 5 на взрослую особь.
Выводы об относительном потенциале A. swirskii и A. cucumeris в распространении конидий B. bassiana до трипсов. Были сделаны выводы, что в данных экспериментальных условиях A. swirskii является лучшим средством биологической борьбы, поскольку он сильнее сокращает количество трипсов и передает конидии большему количеству трипсов, спасающихся от хищников. Однако A. cucumeris может продемонстрировать хороший потенциал как хищника, так и агента распространения энтомопатогенов при использовании в другой ассоциации сельскохозяйственных культур и вредителей. Например, в теплицах из регионов с умеренным климатом было показано, что A. cucumeris показал такие же характеристики, как и A. swirskii, в качестве агента биоконтроля трипса в смоделированных зимних условиях.
Как можно применить такую систему в программе биологического контроля?
Производители выпускают хищных клещей и периодически обрабатывают растения B. bassiana для борьбы с трипсами. Предложенная учеными стратегия не требует двух отдельных обработок, а требует только внесения конидий B. bassiana (технический порошок) в коммерческую упаковку с хищными клещами. Хищные клещи увеличат скорость передачи болезней скрытноживущим вредителям. Общий потенциал хищных видов клещей как агентов распространения патогенов будет зависеть от их способности быть нагруженным конидиями, их способности противостоять патогенным инфекциям и его активности в поисках пищи. Хищные клещи должны быть тесно связаны с целевым вредителем и иметь возможность искать, обнаруживать и взаимодействовать с вредителями на растении, чтобы они могли рассеивать споры на растении и на вредителей

Автор статьи: технолог по защите растений Компании «Био Защита»
Дорошенко Антон
Почта: dav@bio-group.net, телефон: +79100301703
![]()
Оставить комментарий